← Bauer Vertriebs Kg Kündigung Vorlage Barock Muster Wallpaper Basteln Mit Heu Vorlagen →
Werde einser schüler und klick hier https www thesimpleclub de gowie sind metalle gebunden.
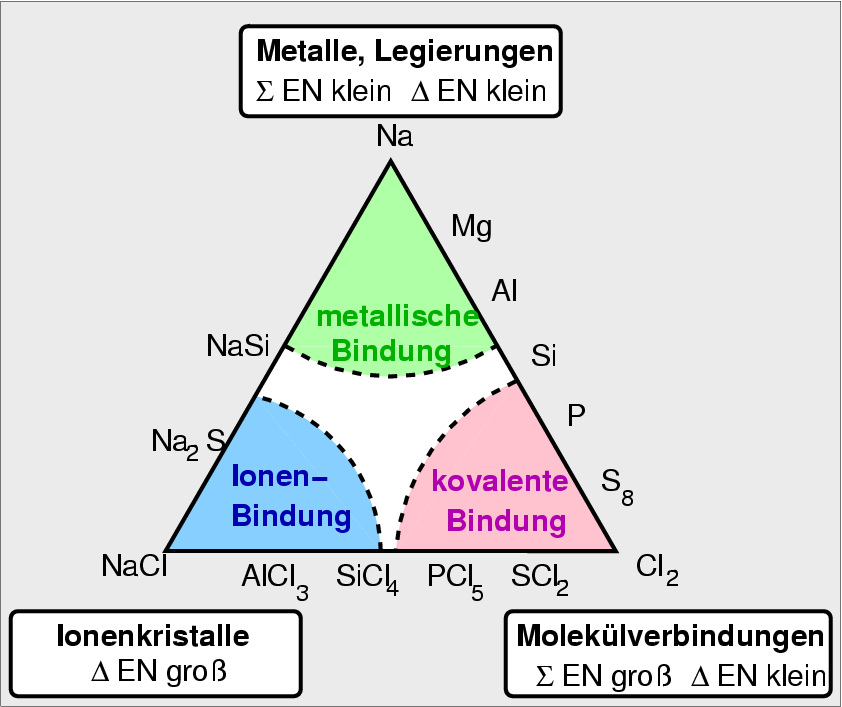
Metallische bindung beispiel. Die metallbindung ist eine art der chemischen bindung die durch anziehungskräfte zwischen metall ionen und freien elektronen verursacht wird. Zwischen verschieden geladenen ionen herrscht elektrostatische anziehung. Ionische und metallische bindung liefern gitter und werden mit verhältnisformeln beschrieben.
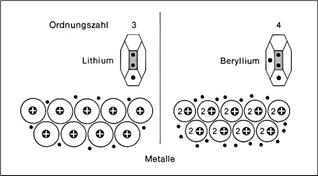
Beryllium hingegen ist in der 2. Warum halten die metallatome eigentlich zusammen. Bei der chemischen bindung haben wir bisher zwei typen auf diese weise kennengelernt.
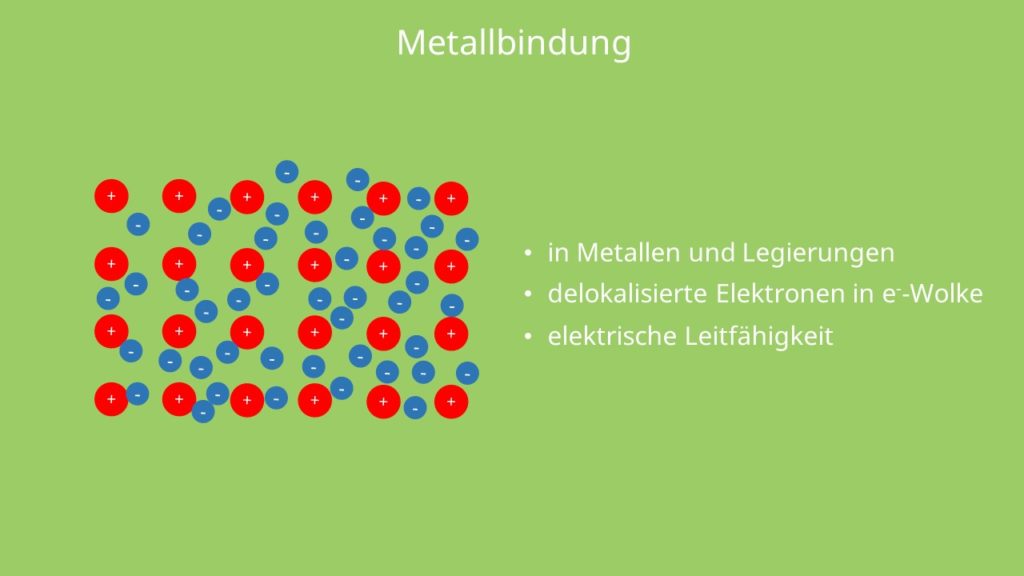
Um dir die metallbindung anhand ein paar beispiele genauer anzuschauen kannst du einen blick auf die linke seite im periodensystem werfen. Diese ist durch das auftreten von frei beweglichen delokalisierten elektronen im metallgitter gekennzeichnet die unter anderem für die makroskopischen eigenschaften elektrische leitfähigkeit metallischer glanz duktilität schmiedbarkeit verformbarkeit verantwortlich sind. Legt man eine elektrische spannung von zum beispiel 6 volt gleichstrom an so fangen die elektronen an sich in eine bestimmte richtung zu bewegen nämlich in richtung auf den pluspol.
Wir haben das bisher im chemieunterricht zum beispiel beim atommodell kennengelernt und haben dort die drei modelle das volumenmodell das kern schale modell und das bohr modell unterschieden. Kovalente und polare bindung liefern moleküle und werden mit molekülformeln beschrieben. Zwischen nichtmetallen und metallen wirken hingegen ionische und zwischen.
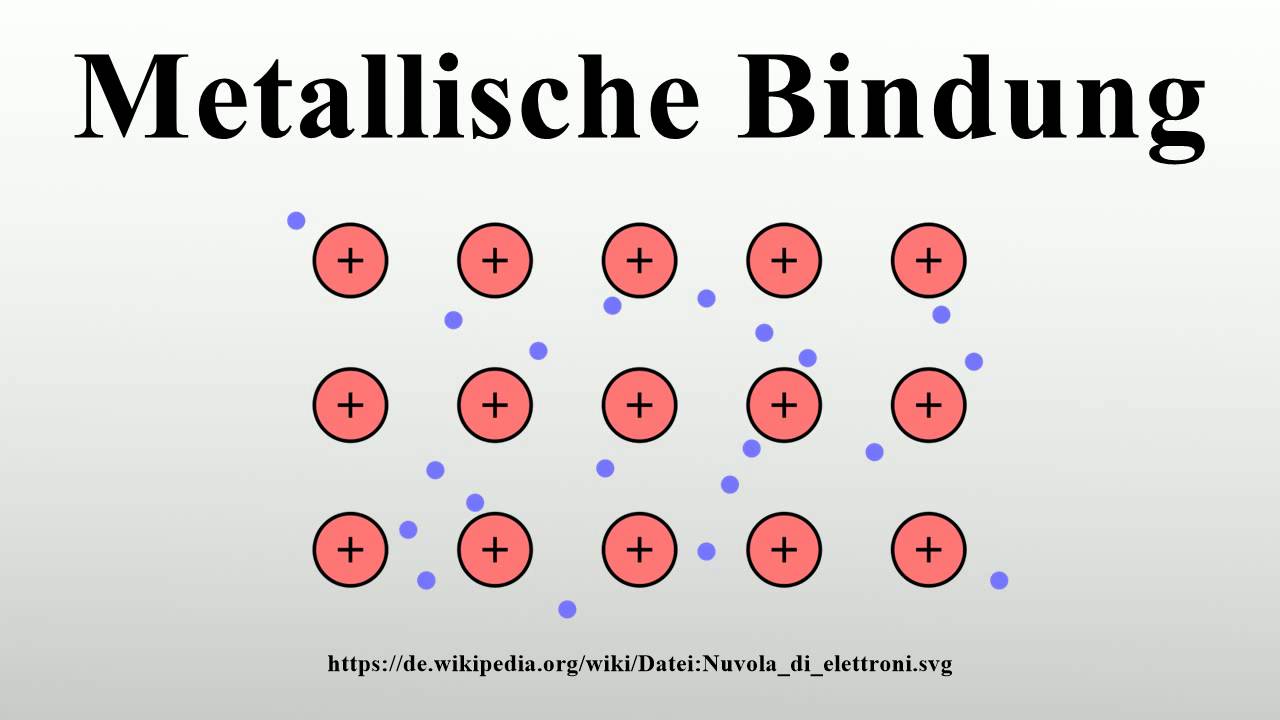
Als metallische bindung oder metallbindung bezeichnet man die chemische bindung wie sie bei metallen und in legierungen vorliegt. Wie du siehst befindet sich lithium in der 1. Wenn das metall verformt wird werden die atomrümpfe und die elektronen lediglich verschoben.
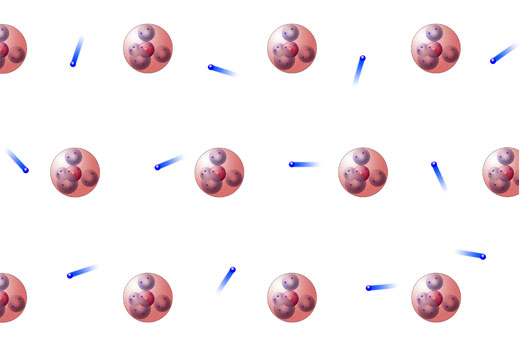
Die atombindung auch kovalente bindung elektronenpaarbindung oder homöopolare bindung ist eine form der chemischen bindungen und ist als solche für den festen zusammenhalt von atomen in vielen chemischen verbindungen verantwortlich. Zwischen molekülen herrschen van der waals oder dipol kräfte. Die elektronen sind frei im metall beweglich.
Die gute verformbarkeit der metalle ist ebenfalls eine folge der metallischen bindung. Eisen kupfer aluminium typische beispiele. Die metallbindung wird durch die starke anziehung zwischen den positiv geladenen atomrümpfen und dem negativ geladenen elektronengas zusammengehalten.
Hauptgruppe und besitzt somit lediglich ein valenzelektron. Im prinzip ist jedes metallstück so es als festkörper vorliegt ein typisches beispiel für eine metallbindung. Die meisten metalle der hauptgruppen besitzen nur wenige außenelektronen die leicht vom metallatom abgegeben werden da die atomkerne auf die außenelektronen nur geringfügige anziehungskräfte ausüben.
Die kovalente und die ionische bindung.